آخرین ارسال های انجمن
| عنوان | پاسخ | بازدید | توسط |
| |
0 | 349 | admin |

| عنوان | پاسخ | بازدید | توسط |
| |
0 | 349 | admin |
گزارش کار آزمایشگاه میکروب شناسی
تست آنتی بیوگرام
آنتی بیوگرام : این تست جهت تعیین حساسیت باکتری ها به آنتی بیوتیک های مختلف به کار می رود
از محیط کشت MHA (MUELLR HINTON AGAR) برای این تست استفاده می شود. از دیسک های حاوی مقادیر مشخص آنتی بیوتیک های مختلف بر روی کشتی از باکتری ها استفاده می شود که باعث نفوذ آنتی بیوتیک در آگار می شود و ناحیه ی موثر توسط باکتری ها به وسیله ی عدم رشد باکتری مشخص می شود. هر چه تاثیر آنتی بیوتیک بر روی باکتری بیشتر باشد قطر هاله ی عدم رشد نیز بیشتر می شود.
وسائل و موارد مورد نیاز برای تست انتی بیوگرام "دیسک دیفیوژن"
استاندارد نیم مک فارلند :
روش انجام کار:
استاندارد نيم مک فارلند سولفات باريم به روش زير تهيه مي شود:
1) 5/0 ميلي ليتر از کلرور باريم BaCl2) )۰/۰۴۸ mol/L(W/V BaCl2/H2O) ۱/۱۷۵% ) را به 5/99 ميلیليتراسيد سولفوريک mol/L (۱% V/V) ۰/۱۸ اضافه کنيد و با هم زدن مداوم يک سوسپانسيون تهيه نمائيد.
2) چگالي صحيح کدورت استاندارد با استفاده از اندازه گيري جذب در اسپکترو فوتومتر با طول مسیر نوري یک سانتی متر، مشخص شود. جذب در ۶۲۵ نانومتر بايد بين 08/0 تا 13/0 باشد.
3 روش برای تست آنتی بیوگرام وجود دارد :
روش انجام تست دیسک دیفیوژن:
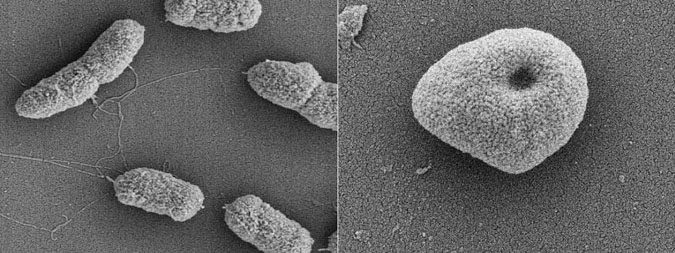
بعد از ایزوله کردن باکتری ، مقداری از کلونی باکتری را به وسیله انس (نه لوپ) برداشته و در سرم فیزیولوژی استریل حل می کنیم . باید در نظر داشت که چون ، در تست آنتی بیوگرام میزان کدر بودن برای ما خیلی مهم است ، بنابراین در انتخاب مقدار نمونه باید دقت کنیم تا نمونه را بیشتر یا کمتر از نیم مک فارلند برنداریم . اگر میزان کدورت کمتر از نیم مکفارلند باشد ، مقداری دیگر از نمونه را در سرم فیزیولوژی استریل حل می کنیم و یا اگر میزان کدر بودن ، بیشتر از نیم مک فارلند باشد در این صورت باید مقداری سرم فیزیولوژی استریل اضافه کرد تا به کدورت مناسب و برابر با نیم مک فارلند برسیم . بعد از تهیه محلول هموژن خود ، با سواب استریل محلول را به هم زده و بعد از آبکشی کردن سواب ، (برای آب کشی ، سواب را با قدرت به دیواره لوله تکیه داده و فشار دهید تا آب آن گرفته شود .) آن را به محیط کشت مولر هینتون انتقال می دهیم و به طور کامل به وسیله سواب ، محیط کشت را به صورت چمنی کشت می دهیم به طوری که هیچ محلی در محیط از قلم نیافتد . بعد از کشت ، دیسک های انتی بیوگرام که قبل از نیم ساعت از تست ، بیرون یخچال قرار داده شده اند را انتخاب و بر روی محیط کشت انتقال می دهیم . باید ذکر کنم که نحوه قرار دادن دیسک ها در محیط کشت مولر هینتون ، به صورت دایره ای است و فاصله این دیسک ها از هم دیگر حدود 12 میلیمتر باشد و باید از دیواره هم فاصله داشته باشند . در ضمن فاصله این دیسک ها را می توان با توجه به تجربه خود کم و یا زیاد کنیم . دیسک های مورد استفاده هم باید با نوع باکتری ایزوله شده ما مناسب باشد مثلا هیچ وقت برای باکتری گرم منفی ، پنی سیلین قرار نمی دهیم چون نسبت به آن مقاوم هستند و یا اینکه آنتی بیوتیک کلروامفینیکل را برای کشت ادرار قرار نمی دهیم چون این انتی بیوتیک نمی تواند وارد مجاری ادراری شود و... بعد از قرار دادن دیسک ها ، در پلیت را بسته و به مدت 24 ساعت آنها را در دمای 37 درجه سانتیگراد ، انکوبه می کنیم (لازم به ذکر است که بنابه به تحقیقات تازه محقین ، دمای انکوبه برای آنتی بیوگرام به ۳۵ درجه کاهش یافته است و مدت زمان آن هم به ۱۶ تا ۱۸ ساعت کاهش یافته است ) . بعد از 24 ساعت پلیت را زیر چراغ برسی می کنیم .آنگاه ميبايد قطر هاله عدم رشد را با خطكش اندازه گيري کرد و با توجه به جدول همراه دیسک ها ، گزارش تست انتی بیوگرام خود را برای هر یک از انتی بیوتیک ها ، به صورت حساس (Susceptible ) ،مقاوم (Resistant) و یا نیمه حساس (Intermediate) گزارش می شود .
همان طور که مشاهده می کنید در اطراف برخی از دیسک ها هاله روش وجود دارد که این نشان دهنده حساس بودن ان بکتری به ان دیسک است و باید حساس گزارش شود . همچنین در اطراف بعضی از دیسکها هیچ گونه هاله ای نیست در این حالت این باکتری را باید نسبت به ان دیسک مقاوم گزارش داد . اگر طبق جدول خود هیچ یک از حالات فوق مشاهده نشود در اینصورت نیمه حساس را گزارش می کنیم .
و چند نکته مهم :
گزارشکار آزمایشگاه میکروب شناسی
رنگ آمیزی کپسول
رنگ آمیزی کپسول
اهداف
-مشاهده كپسول باكتري
-آشنايي با ساختاروكاربرد كپسول درباكتري
مقدمه
بعضی از باکتریها ماده لزجی از خود ترشح می کنند که خارج از سلول و پیرامون آن جمع می شود و دیواره سلولی را می پوشاند . این لایه کپسول نامیده می شود که ضخامتهای متفاوت و چسبندگی متغیر دارد. اندازه کپسول به محیط کشت میکروبی بستگی دارد و همچنین باکتریهای بیماریزا ، در بین باکتریهای تولید کننده کپسول ، کپسولهای بزرگتری دارند. جنس این کپسول از پلی ساکارید است که در آب محلول و غیر یونی است .
کاربرد کپسول در باکتریها :
کپسول بعنوان یک سد اسمزی بین باکتری و محیط اطراف آن عمل می کند و در واقع نقش حفاظتی دارد. کپسول مانع از عمل بیگانه خواری گلبولهای سفید می شود همچنین بعنوان مخزن ذخیره مواد غذایی یا دفع مواد زائد هم می تواند عمل کند.
در تعدادی از باکتریهای بیماریزا ، وجود کپسول شدت بیماریزایی و عفونت زایی را افزایش می دهد و ممکن است حتی این بیماریزایی به وجود کپسول بستگی داشته باشد . مثلا در استرپتوکوکوس پنومونیا اگر توانایی تولید کپسول در باکتری از بین برود این باکتری غیر بیماریزا می شود.
در عمل رنگ آمیزی شرط رنگ گیری یک سلول یونی بودن آن می باشد یعنی وقتی سلول حالت یونی داشته باشد هنگام رنگ آمیزی بین نواحی یونیزه سطح سلول و اجزای یونیزه مولکولهای رنگ پیوند بوجود می آید . در نتیجه بین بارهای مخالف موجود در سطح سلول و مولکولهای رنگ پیوند یونی تشکیل می شود و باکتری رنگ می گیرد . اما چون کپسول را بعلت غیر یونی بودن آن نمی توان رنگ آمیزی کرد در نتیجه برای دیدن آن در زیر میکروسکوپ ، زمینه باکتری رنگ آمیزی می شود و در نتیجه امکان دیدن کپسول باکتری که بصورت بیرنگ ظاهر می شود ، فراهم می شود. این روش را رنگ آمیزی منفی می نامند.
در این روش رنگ آمیزی برای تثبیت گسترش از حرارت استفاده نمی شود . چون در اثر حرارت ، باکتری در داخل کپسول از شکل طبیعی خود خارج می شود.
روش انجام:
روش جوهر هندی : ابتدا یک لام تمیز برداشته و یک قطره از سوسپانسیون باکتری را روی آن می گذاریم . سپس یک قطره جوهر هندی در کنار آن می گذاریم و با یک لام دیگر با زاویه 45 درجه روی آن میکشیم و گسترش را تهیه میکنیم و در دمای اتاق خشک میکنیم . سپس با روغن ایمرسیون و عدسی 100 مشاهده میکنیم
روش Hiss
در ان روش یک قطره سرم فیزیولوژِی را روی لام می گذاریم و بوسیله لوپ مقداری کلنی باکتری را در آن حل می کنیم و در دمای اتاق اجازه می دهیم تا خشک شود . سپس 2دقیقه با رنگ کریستال ویوله آغشته میکنیم و با سولفات مس لام را می شوییم . و بعد از خشک شدن با عدسی 100 مشاهده می کنیم
جسم باکتری : آبی تیره / کپسول آبی کمرنگ
روش سوم : یک قطره سرم فیزیولوژی وسط لام قرار داده کلینی باکتری را درونش حل میکنیم . و به ان یک قطره رنگ نیگروزین اضافه میکنیم . و پس از خشک شدن به مدت 1-2 دقیقه با رنگ متیلن بلو آغشته کرده و بعد از شستشو زیر میکروسکوپ مشاهده میکنیم
کپسول هاله شفاف / جسم آن آبی تیره
نتيجه گيري
از انجام آزمايش فوق نتيجه ميگيريم كه باكتري كلبسيلاپنومونيه داراي كپسول است.و كپسول آن طبق اين آزمايش به صورت رنگ نشده در زمينه تاريك در زير ميكروسكوپ مشاهده مي شود.
گزارشکار آزمایشگاه میکروب شناسی
آشنایی با انواع روش های کشت
آشنایی با روش های کشت :
کشت در پلیت : به سه روش قابل انجام است
1- کشت خطی
2- کشت سطحی
3- کشت آمیخته یا پورپلیت
روش کشت خطی :
در این روش از محیط پیش ریخته استفاده می شود. به این ترتیب که ابتدا بوسیله یک آنس سترون شده مقداری از پرگنه باکتری را برداشته و آنرا روی سطح محیط پیش ریخته بصورت خطهای موازی و در چند جهت می کشید . در کشتهای خطی برای بدست آوردن کلنی های تک می توانید پلیت را به 4 قسمت تقسیم کنید بعد در قسمت اول ابتدا نوک آنس را که محتوی پرگنه باکتری است را بصورت خطهای موازی کشیده و بعد خطوط را در منطقه دوم از انتهای خط انتهایی منطقه اول در جهت دیگر ادامه می دهید و در منطقه سوم و چهارم هم به همین صورت عمل می کنید . خصوصیت این روش این است که وقتی خطوط موازی را روی سطح محیط می کشید به ترتیب از تراکم باکتریها کاسته می شود و به انتهای خط که می رسید تراکم باکتری کمتر است و در منطقه دیگر وقتی از انتهای خط منطقه قبلی استفاده می کنید در واقع تراکم بسیار کمتر از تراکم باکتریها در ابتدا می باشد و در نتیجه در مناطق دیگر هم به ترتیب از تعداد باکتریها کاسته می شود تا جائیکه در منطقه چهارم شما می توانید پرگنه های تکی داشته باشید که کلنی خالص نامیده می شود. بنابراین انجام درست کشت خطی منجر به ایجاد کلنی خالص می شود این کلونی تنها از یک باکتری مادری بوجود می آید (تعریف کلنی خالص). باکتریهای منفرد را باکتریهای مادر می نامند که این باکتریها پس از کشت خطی و جدا شدن سلولهای باکتری از یکدیگر بوجود می آیند.
توجه داشته باشید که کلنی خالص به کلنی گفته می شود که با کلنی دیگر تماس نداشته باشد.
در مورد محیطهای کشت باکتریایی که بصورت مایع می باشند برای انجام کشت خطی روی محیط پیش ریخته فقط یکبار لوپ را داخل محیط محتوی باکتری کرده و یک لوپ از آن بردارید سپس آنرا روی محیط پیش ریخته قرار داده و بصورت خطوط موازی آنرا در چند جهت بکشید.و یا مراحل فوق را روی آن انجام دهید.
کشت سطحی :
در این نوع کشت هم از محیط پیش ریخته استفاده می شود.
نحوه کشت :
این روش کشت بیشتر برای محیطهای مایع میکروبی کاربرد دارد و یا اگر محیط مایعی مانند شیر مشکوک به آلودگی میکروبی باشد آن را می توان به این روش کشت میکروبی داده و میکروارگانیسمهای موجود در آن را مشخص نمود.
برای اینکار ابتدا یک رقت معینی از محیط مایع تهیه نمائید. سپس با استفاده از پیپت استریل مقدار مشخصی از آن رقت را برداشته و در سطح محیط جامد پیش ریخته توسط میله پخش کننده یا توک آنس پخش نمائید. و بعد از انکوباسیون می توانید کلنی های رشد یافته در سطح محیط کشت را مشاهده کنید توجه داشته باشید که هنگام انجام کشت سطحی باید سطح محیط خشک باشد .
چون هنگام ریختن محیط کشت بصورت پیش ریخته ممکن است بخار آب روی درب پلیت و سطح محیط جمع شود برای خشک کردن آن می توان محیطها را در یک گرمخانه با دمای 50-25 درجه قرار داده و خشک نمود.به این ترتیب که درب پلیت را برداشته و قسمت محتوی محیط کشت را وارونه روی لبه درب قرار دهید تا قطرات رطوبت حذف گردد.
همچنین می توانید پس از ریختن محیط کشت در پلیت در صورت تجمع حباب هوا ، آنها را با شعله دادن سطح محیط حذف نمائید. اینکار باعث سترون شدن سطح محیط کشت هم می شود.
کشت آمیخته یا پورپلیت :
در این روش کشت هم نیاز به تهیه سوسپانسیون از باکتری می باشد . یعنی باید از باکتری مورد نظر در محیط مایع رقت معینی را تهیه نموده بعد به میزان 1 سی سی از آنرا در کف پلیت استریل ریخته سپس از محیط کشت مورد نظر که قبلا استریل شده و حرارت آن به حدود 45 درجه سانتیگراد رسیده بمیزان 15-20 سی سی به پلیت اضافه نمائی. سپس با حرکات دورانی بصورت عدد 8 انگلیسی آنرا کاملا مخلوط کنید. اگر نیاز بود مجددا سطح محیط آمیخته با باکتری را با یک لایه نازکی از همان محیز کشت بپوشانید دراینحالت به آن کشت دولایه هم گفته می شود

گزارش کار آزمایشگاه میکروب شناسی
آشنایی با انواع محیط های کشت

محیط های متداول در کشت میکربی و نحوه تهیه آنها :
بطور کلی محیط های کشت باید دارای مشخصات معینی باشند و هنگام تهیه و
استفاده از محیط کشتها باید به نکات زیر توجه شود :
تمام محیط کشتها باید واجد مواد غذایی ضروری برای رشد میکروبها باشند
PH محیط کشت باید در حد معین قبل از استفاده برای کشت تنظیم شود.
ظروف مورد استفاده برای تهیه محیط کشتها باید کاملا تمیز و عاری از
مواد خارجی باشند .
آب مقطر مورد استفاده باید بطریقه صحیح تهیه شود .
درجه حرارتی که برای استریل کردن محیط کشت مصرف می شود باید نسبت به
نوع مواد غذایی مربوط در محیط کشت در نظر گرفته شود . درجات بالا باعث از بین رفتن
برخی از مواد شیمیایی موجود در محیط کشت می شوند .
محیط های کشت باکتریها به سه صورت زیر تهیه میشود :
محیط کشت مایع ( براث ) : این محیط فاقد آگار و فقط در لوله آزمایش یا فلاسک استفاده میشود . مثل محیط نوترینت براث.
نیمه جامد : 5% آگار دارد و برای تست حرکت باکتری ها استفاده می شود
جامد : دارای ترکیبی به نام آگار که از جلبک قرمز دریایی تهیه می شود
محیط های کشت باکتری را از نظر نوع مواد تشکیل دهنده و از نظر کاربرد
به چهار دسته تقسیم می کنند:
محیط کشت پایه (Basic Media)
:
انواع محیط های کشت
محیط نوترینت براث (Nutrient broth ):
چنانچه ماده آگار را به نسبت 5/1 تا 2 درصد با آبگوشت غذایی مخلوط
کنیم، این آگار غذایی بدست میآید . این محیط مبنای تهیه انواع و اقسام محیط های
کشت جامد مثل Blood Agar ,
Chocolate agar می باشد .
محیط آگار خوندار (Blood agar)
:
اغلب نمونه های رسیده به آزمایشگاه میکروب شناسی بر روی محیط آگار
خوندار کشت داده میشوند، چون این محیط از رشد تمام واغلب باکتریهای سخت رشد حمایت
کرده و اغلب میکروب شناسان عادت دارند بر اساس مورفولوژی کلنی بر روی آگار خوندار تصمیم
گیری نمایند . این محیط از یک محیط پایه مانند تریپتون که منشاء پروتئینی دارد،
کلرید سدیم آگار و 5 درصد خون تشکیل شده است . برخی باکتریها آنزیم های خارج سلولی
تولیدکرده که بر روی گلبولهای قرمز عمل کرده و آنها راکاملاً لیز میکند
(همولیزبتا ) یا یک تغییر سبز رنگ در اطراف کلنی ایجاد میکند ( همولیز ناقص یا
آلفا ) در صورتی که برخی از باکتریها تغییری ایجاد نمیکنند ( همولیزگاما) تولید
همولیزین بوسیله باکتری به بسیاری از فاکتورهای محیطی مانند PH ، اکسیژن و دما بستگی دارد. میکروب شناسان
اغلب از مورفولوژی کلنی و تولید همولیزین به عنوان آزمایشات غربالگری اولیه جهت
کمک به تصمیم در انتخاب مراحل دیگر جهت شناسایی یک باکتری استفاده میکنند. جهت
مطالعه درست واکنش همولیتیک بر روی آگار خوندار، کارشناس بایستی پلیت را در مقابل
نور گرفته و مشاهده نماید. اگر از لوپ جهت کشت خطی بر روی آگار خوندار استفاده میشود
باید آنرا در آگار فرو برده ( Stabbing) تا
ارگانیسم بتواند در زیر سطح محیط که اکسیژن کمتری دارد رشدکند . تولید همولیزین
های حساس به اکسیژن در برخی از ارگانیسم ها بدین وسیله تشدید میگردد . به روش
دیگر، میتوان پلیتها را جهت مشاهده واکنش همولیزین حساس به اکسیژن به طریق بی
هوازی نیز انکوبه نمود
محیط مک کانکی (Mac conkey agar) :
.Mannitol salt agar
يك محيط انتخابی براي تمايز استافيلوكوكهاي پاتوژن مانيتول سالت آگار است. غلظت بالاي نمك(7.5%) در اين محيط مانع از رشد بيشتر ميكروارگانيسمها مي شود.نه تنهااستافيلوكوك هاي پاتوژن مي توانند در اين محيط رشد كنند بلكه آنها در اين محيط اسيد هم توليد مي كنند.اين اسيد توليد شده به عنوان شاخصpH موجب تغيير رنگ محيط از قرمز به زرد مي شود. استافيلوكوك هاي غير باتوژن نيز قادر به رشد در اين محيط هستند ولي نمي توانند اسيد توليد كرده رنگ آن را تغيير دهند.
رنگ آمیزی گرم
اصول:
در آزمايشگاه ميكروب شناسي باليني، رنگ آميزي گرم آزمايشي مهم براي تشخيص احتمالي سريع عوامل عفوني است و كيفيت نمونه هاي باليني را ارزيابي مي كند . اين آزمايش براي طبقه بندي باكتري ها بر اساس شكل، اندازه، مورفولوژي سلول و واكنش گرم آنها به كار مي رود.
تفسير گسترش هايي كه رنگ آميزي گرم شده اند، با در نظر گرفتن مشخصه هاي رنگ آميزي ، اندازه، شكل و آرايش سلول صورت می گيرد. اين مشخصه ها ممكن است بوسيله بسياري از فاكتورها مانند مدت زمان ماندگی پليت ها، محيط کشت، اتمسفر انكوباسيون ، روش رنگ آميزي و وجود مواد مهاركننده تحت تأثير قرار بگيرند. براي تفسير اسميرهاي تهيه شده از نمونه هاي باليني مانند خلط، به وجود عوامل اضافي مانند انواع سلول هاي ميزبان و فاگوسيتوز نيز می بايست دقت نمود .

مواد:
A. معرف ها
معرف ها ممكن است به صورت تجاري خريداري شوند يا در آزمايشگاه تهيه گردند.
احتياط: يد خاصيت خورندگي دارد. از استنشاق، خوردن يا تماس آن با پوست خودداري كنيد.
.c رنگ برها :
1) كندترين رنگ بر: اتانول 95 %
2) رنگ بر متوسط: استون ـ الكل؛ مخلوطي از ml 100 اتانول 95% و ml100 استون (reagent grade ) را در بطري شيشه اي قهوه اي رنگ تركيب كنيد، با يك سال تاريخ انقضاء، برچسب بزنيد و در حرارت اتاق نگهداري كنيد.
3) سريع ترين رنگ بر: استون (reagent grade )
احتياط: اتانول و استون قابل اشتعال هستند.
Counterstains (رنگ متقابل) : سافرانين
.B وسايل و مواد مورد نياز
1- لام شيشه اي
2- پي پت پاستور و اپليكاتور چوبي استريل
3- لوپ ، آنس
4- روغن ايمرسيون
نكته: متانول را در بطري هاي درپيچ دار قهوه اي ذخيره كنيد. ذخيره كاري را مي توان در ظروف پلاستيكي براي حداكثر دو هفته ذخيره نمود .
روش انجام آزمایش :
1) تهیه اسمیر : برای تهیه اسمیر از لام های شیشه ایی نو و تمیز استفاده می کنیم که 2 حالت دارد :
2) خشک کردن : یا روی میز یا نزدیک شعله خشک میکنیم
3) مرحله فیکساسیون : 3 بار به آرامی از شعله رد می کنیم که پروتئین ها دناتوره می شوند و به لام محکم می چسبند
4) رنگ آمیزی :
اولین رنگ : کریستال ویوله
مقداری از رنگ را با پیپت پاستور می کشیم و میریزیم روی لام و 1 دقیقه زمان می دهیم ، سپس لام را بر می گردانیم و میگیریم زیر شیر آب
سپس استون الکل که سبس حل شدن چربی های دیواره سلولی باکری می شود
باکتری های گرم مثبت : مانع خروج رنگ می شود
گرم منفی : با اضافه شدن استون الکل از حفره های دیواره اش رنگ خارج می شود
سپسس افارین اضافه میکنیم و پس از 30 ثانیه زیر آب شستشو می دهیم .
در گرم منفی ها : قرمز
در گرم مثبت ها : بنفش
نمونه های ازمایش :
گرم مثبت کوکسی : استافیلوکوک
باسیل گرم منفی : e-coli
گزارش کار آزمایشگاه میکروب شناسی
قسمت 1 : آشنایی با وسایل آزمایشگاه میکروب شناسی

فيلدو پلاتين(Wire loop)
وسيله ايست كه از يك ميله به طول 4 سانتي متر ساخته شده است و داراي سر و دسته مي باشد . جنس سر آن از پلاتين يل كروم است . اگر چنانچه سر آن به صورت حلقه باشد به آن فيلدو پلاتين حلقوي (Loop ) گفته ميشود كه از اين وسيله براي كشت دادن باكتري ها در محيط هاي مختلف و يا براي انتقال مقداري از كلني باكتري از يك محيط كشت به محيط كشت ديگر استفاده مي شود . اگر سر فيلدو پلاتين نوك تيز باشد به آن آنس (Once ) گفته ميشود كه از آن براي انتقال دادن باكتري ها و همچنين كشت دادن باكتري هادر محيط كشت هاي لوله اي (کشت های عمقی ) استفاده ميشود .
اگر سر آن گرد باشد به آن لوپ می گوییم برای انجام کشت های سطحی
در آزمايشگاه سر فيلدو پلاتين را پيش از كشت ، روي شعله استريل و در محيط بدون نمونه سرد ميكنند سپس نمونه برداري و كشت باكتري را انجام مي دهند.
اسلايد(Slide)
در كارهاي ميكروب شناسي لام هاي مختلفي مورد استفاده قرار ميگيرد . ساده ترين نوع لام از جنس شيشه و صاف است ،كه جهت رنگ آميزي باكتري ها استفاده ميشود . نوع ديگري از لام وجود دارد كه داراي يه قسمت گود است و به آن لام گوده دار ميگويند كه براي ديدن باكتري هاي زنده به كار مي رود .
لام ديگري به نام لام شمارش وجود دارد كه در قسمت وسط داراي مربعي است به ضلع يك ميلي متر با تقسيمات 12 تايي به عمق يك ميلي متر ، اين لام براي شمارش باكتري و گلبول هاي سفيد و قرمز خون و يا شمارش ميكروارگانيسم هاي كوچك در حجم مشخصي مورد استفاده قرار مي گيرد و به نام لام نئوبار موجود است .
لوله هاي كشت(Culture tubes)
انواعي از لوله هاي آزمايش در آزمايشگاه ميكروب شناسي مورد استفاده قرار ميگيرد . يكي از آنها لوله آزمايش معمولي است كه زيلد مورد استفاده قرار مي گيرد ، اين لوله ها براي رشد و تكثير ميكروارگانيسم ها در محيط كشت مصنوعي ( جامد يا مايع ) بكار مي رود . دهانه اين لوله ها را با پنبه مي بندند . دهانه بعضي از لوله ها به جاي پنبه ممكن است با فلز زنگ نزن مسدود نمايند . اين لوله ها را كه دهانه آنها بهتر بسته ميشود لوله آزمايش مورتون (Morton) گويند . براي بعضي لوله ها آزمايش ، به نام هاي در پيچي در هاي لاستيكي و پلاستيكي استفاده مي شود .
پيپت(Pipette) :
پاستور ( حجم های کم و بدون نیاز به دقت ) ، مدرج ( حجم های کم و دقیق )
يكي از وسايل شيشه اي مفيد در ميكروب شناسي كاربردي پيپت است كه براي انتقال مقدار معيني مايع از محيطي به محيط ديگر به كار مي رود . مايع براي جلوگيري از آلودگي به وسيله پيپت منتقل ميشود. پيپت لوله شيشه اي مدرجي است كه نوك باريكي دارد . در طرف ديگر قسمت دهاني است كه با مكيدن از آن ، مايع به داخل پيپت كشيده مي شود. با كنترل پيپت توسط انگشت نشانه ميتوان مقدار لازم از محلول مورد نظر را برداشت.
انكوباتور(Incubator)
دستگاهي است كه درجه حرارت مناسب رشد ، تكثير و تشكيل كلني را فراهم ميكند و درجه حرارت ثابتي را كنترل ميكند و چون اكثر باكتري ها پاتوژن هستند معمولا روي درجه حرارتي تقريبا برابر دماي بدن انسان 37 درجه سانتي گراد تنظيم ميشود.
بن ماري يا حمام آب گرم(Water bath)
يك وسيله نيمه پر شده از آب مقطر است. زماني كه نياز به حرارت غير مستقيم باشد ، از اين دستگاه استفاده ميشود كه روي درجه حرارت هاي گوناگون براي هدف هاي مورد نظر تنظيم ميشود .
ديسك هاي آنتي بيوتيك(Antibiotic disk)
ديسك هاي كاغذي حاوي دارو مي باشد كه براي تعيين ميزان حساسيت باكتري به انواع آنتي بيوتيك ها استفاده مي شود.
پلیت (Plate)
ظروفي هستند دو جداره ، كه در جدار كوچك محيط كشت باكتري ريخته ميشود و از جدار بزرگ به عنوان درب پليت استفاده ميشود. پليت ها ممكن است پلاستيكي ( يكبار مصرف ) و يا شيشه اي (با مصرف مجدد ) ساخته شوند . محيط در پليت ها به صورت جامد تهيه ميشوند كه داراي سطح كشت ميكروبي وسيع مي باشند.
پليت ها محلي براي رشد ميكروارگانيسم در كشت هاي ساخته شده ، مي باشند كه پس از كشت به صورت وارونه انكوبه ميشوند . اين عمل از جمع شدن آب در محيط كشت و پخش شدن كلني ها پيشگيري ميكند
اسلاید های میکروب شناسی دکتــــــر ســـــــــــــــــــــــاده
( قسمت اول )

اندازه فایل : 13mb
محیط کشت
مقدمه:
برای مطالعه میكروارگانیسم ها باید بطریقی آنها را بر روی محیطهای مناسب از نظر شرایط فیزیكی و شیمیایی كشت داد . مطالعه زیاد درباره میكروارگانیسم ها و نحوه زندگی آنها باعث شده كه تا كنون انواع زیادی از محیط كشت با تركیبات متفاوت به طور مصنوعی برای استفاده در آزمایشگاههای میكروبیولوژی تهیه شود . هرچند انواع این محیط كشت ها زیاد می باشند، معهذا در مواردی برای كشت نوع بخصوصی از یك میكروارگانیسم باید از یك نوع محیط كشت بخصوص با تركیبات مشخص استفاده شود.

ابتدا باتوجه به مندرجات حک شده بروی جعبه اگار وباتوجه به محاسبات مقدار gr0.8 اگار را برمیداریم وداخل ارلن تمیز واستریل میرزیم.سپس به انcc10اب مقطر اضافه میکنیم وروی هینر میگذاریم تااگار خوب حل شودومحلولی شفاف به ما بدهد.( در اینجا دما از 60نباید بالاتر برود).سپس صبر میکنیم محلول تا دمای 45 درجه سانتی گراد سردشود سپس به ان خون را اضافه میکنیم وداخل پلیت میرزیم ومیگذاریم خودش را بگیرد.هنگامی که خود را گرفت در ظرف را گذاشته و انرا برمیگردانیم ودر داخل یخچال نگه داری میگردد
دانلود در ادامه مطلب ... |